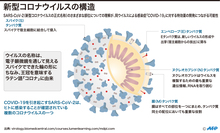
アストラ製ワクチン、血栓は「非常にまれな」副反応 欧州当局が認める
このニュースをシェア
【4月7日 AFP】(更新)欧州医薬品庁(EMA)は7日、英製薬大手アストラゼネカ(AstraZeneca)製の新型コロナウイルスワクチンについて、血栓発症を「非常にまれな」副反応として認定すべきだとの見解を示した。ただ、接種によるメリットはリスクを上回るとしている。
EMAによると、年齢など特定のリスク要因は現時点では確認されておらず、まれに起きる血栓症は免疫反応に起因している可能性がある。
アストラゼネカ製ワクチンについては、接種後の脳血栓発症報告が数十例あり、死者も出ていることから、複数の国が接種を見合わせている。
EMAは声明で「EMAの安全委員会はきょう、アストラゼネカ製ワクチンの非常にまれな副作用(副反応)として、血小板減少を伴う異常な血栓を認定すべきだと結論付けた」と発表。ただ、新型コロナウイルス対策の一環として、接種は継続すべきだとの見解を強調した。
EMAのエマー・クック(Emer Cooke)長官は記者会見で「安全委員会は、新型コロナウイルス感染症(COVID-19)予防の点で、アストラゼネカ製ワクチンの有用性が全体として副作用のリスクに勝ることを確認した」と説明。同ワクチンは「命を救っている」と述べた。
血栓症例は多くが55歳未満の女性で報告されており、複数の国が接種対象を高齢者に限定している。だが、EMAはリスクのあるグループを特定できなかったと言明。クック氏は「このまれな事象は全年齢でみられており、年齢、性別、病歴など特定のリスク要因を確認できない」とし、「これらのまれな副作用についての妥当な説明は、ワクチンに対する免疫反応だ」と述べた。(c)AFP